A Anvisa liberou o uso emergencial da vacina de Oxford, A Astrazeneca, e da CoronaVac, do Butantan, contra o Covid-19.
Foi liberado neste domingo (17) pela Agência Nacional de Vigilância Sanitária (Anvisa) o uso emergencial da vacina de Oxford e da CoronaVac contra o Covid-19, vírus que já provocou a morte de mais de duzentas mil pessoas por todo o território brasileiro.
Logo após a aprovação, o governo de São Paulo realizou a primeira vacinação no Brasil. Mônica Calazans, enfermeira de 54 anos, já havia sido voluntária na terceira fase dos testes da vacina, que apresentou uma taxa de eficácia geral de 50,38%.
A decisão a favor do uso emergencial das vacinas veio ao encontro do atual cenário de aumento do número de casos no Brasil e a ausência de alternativas terapêuticas aprovadas para prevenção e tratamento da doença.
Entenda os pedidos
 Imagem: Mongkolchon Akesin/iStock
Imagem: Mongkolchon Akesin/iStock
Apresentado em 8 janeiro pelo Instituo Butantan, o pedido para o uso emergencial da CoronaVac, que também será produzida no Brasil, é referente a 6 milhões de doses importadas da farmecêutica chinesa Sinovac.
A aprovação do pedido do Butantan foi condicionada à assinatura de um termo de compromisso, que prevê o envio dos resultados sobre a imunogenicidade da CoronaVac. O Instituto terá, então, de enviar até o dia 28 de fevereiro os resultados sobre a capacidade da vacina em produzir anticorpos.
Em coletiva de imprensa, o governador João Dória declarou que a vacinação contra o Covid-19 começará em hospitais de referência e nas populações indígenas. Entretanto, não deu detalhes sobre quantidades de vacinações no Estado, que apresenta o maior índice de mortes.
Leia também: conheça o plano de vacinação do Ministério da Saúde contra o Covid-19
Na mesma coletiva, Dimas Covas, diretor do Instituto Butantan, disse que das 6 milhões de doses, 4.636.936 serão enviadas para o governo federal. Já as outras 1.357.640 serão distribuídas pelo estado de SP.
Já o pedido feito pela Fundação Oswaldo Cruz (Fiocruz) para o uso emergencial da vacina feita em parceria com a universidade de Oxford foi enviado no dia 8 de janeiro.
A AstraZeneca, que também vem sendo desenvolvida no Brasil, demonstrou eficácia de 70,4%. Serão 2 milhões de doses, que nesse primeiro momento serão importadas do laboratório Serum, da Índia.
Vacinação em massa
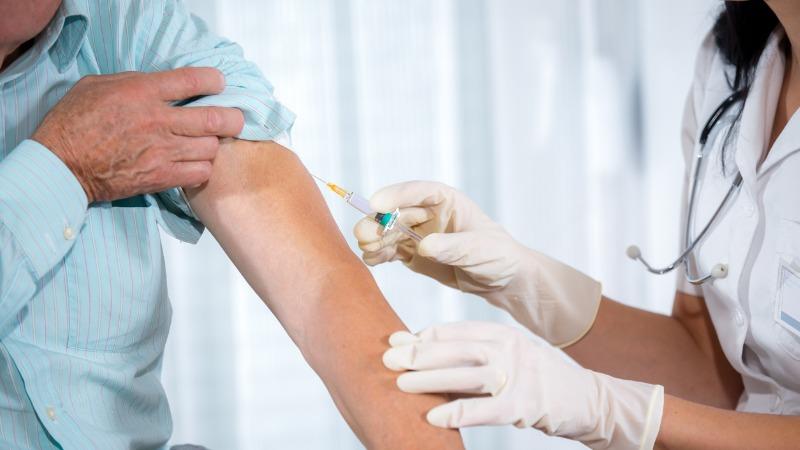 Imagem: Jovanmandic/iStock
Imagem: Jovanmandic/iStock
Aprovados, os dois imunizantes ainda não podem ser comercializados, apenas distribuídos no sistema público de saúde. Para que os laboratórios sejam autorizados a promover a venda de vacinas e a vacinação em massa da população é necessário pedir registro à Anvisa.
Até o momento, nenhum laboratório fez este pedido. A expectativa da Fiocruz é que o pedido seja feito até sexta-feira (22).
Inicialmente, as doses das vacinas serão destinadas às pessoas de grupos de risco como indígenas, idosos e profissionais de saúde.